
Propiedades de las sustancias
Como ya se mencionó cada sustancia tiene un conjunto de propiedades que la diferencias de los demás. Una caracterización completa de una sustancia puede involucrar la determinación de muchas propiedades físicas y químicas. No obstante hay varias propiedades que nos pueden ser de gran utilidad en la identificación primaria de muchas sustancias químicas en el laboratorio. Para ello es preciso acudir a determinados ensayos que nos darán los valores cuantitativos y cualitativosde estas propiedades. En principio algunas de estas propiedades son:
Estado físico y propiedades organolépticas en condiciones normales (color, olor, sabor).
El punto de fusión (temperatura de paso del estado sólido al líquido).
El punto de ebullición (temperatura de paso del estado líquido al gaseoso).
Densidad (relación masa volumen).
El índice de refracción.
Solubilidad en diferentes solventes.
Propiedades ópticas, incluyendo los espectros característicos.
Propiedades químicas (acidez, composición elemental, masa molecular, reacción con reactivos específicos, formación de derivados).
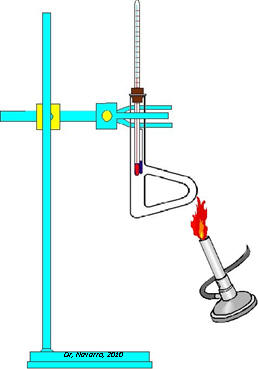
La determinación del punto de fusión se aplica a sustancias que en condiciones normales vemos en estado sólido. Igualmente la determinación del punto de ebullición se le realiza comúnmente a sustancias que en las condiciones normales están en estado líquido. Una forma clásica de determinar el punto de fusión consiste en colocar una pequeña cantidad de muestra en un tubo capilar, que se coloca a su vez en un tubo de Thiele (ver figura 1), el cual permite un calentamiento uniforme y gradual. Cuando se nota que se forma una gotita de líquido o que la sustancia se reblandece, se lee la lectura del termómetro. Esta determinación se realiza hoy en día en aparatos automatizados como el Fisher-Johns (figura 2). Es bueno señalar que la temperatura de fusión puede indicarnos el grado de pureza de una sustancia. Las sustancias puras generalmente funden en un rango estrecho. La observación de un rango amplio en la temperatura de fusión, indica que hay una mezcla de al menos dos sustancias.


Figura 1 Figura 2
Para la determinación del punto de ebullición se pueden utilizar técnicas macro, mini y micro. La determinación macro consiste en montar una unidad de destilación. Este método es relativamente exacto (± 5 ºC), con la ventaja de que al determinar el punto de ebullición se purifica de una vez la muestra. Como desventajas tenemos que se emplea bastante muestra (más de 5 ml) y se emplea un tiempo considerable.
A escala mini se colocan aproximadamente 2 ml de la muestra en un minitubo y el termómetro se coloca a 1.5-2.5 cm de la superficie. Se calienta suavemente y se determina el punto de ebullición cuando se condensan las gotitas del compuesto en el termómetro (figura 3).
La determinación micro se hace con un capilar cerrado por un extremo, que se inserta con el extremo abierto hacia abajo en un tubo pequeño donde se ha depositado la muestra problema hasta una altura de 1.5 cm aproximadamente (figura 4). Para sostener al capilar se le coloca un pedazo de capilar encima. Todo este dispositivo se puede colocar dentro de un tubo de Thiele por ejemplo, para logran un calentamiento suave y uniforme. Al calentar la muestra, del interior del capilar comienzan a salir al principio burbujas de aire, y su interior se va llenando de vapores de la sustancia, saliendo las burbujas más lentamente. En el momento en que la presión de estos vapores iguala la atmosférica, dejan de salir burbujas y el líquido penetra en el capilar, y esta temperatura se toma como la temperatura de ebullición de la sustancia bajo ensayo.
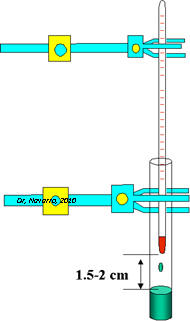

Figura 3 Figura 4
Para la realización de muchos procesos es necesario determinar la cantidad de sustanci que se emplea e los mismos. Para ello normalmente se pesa la sustancia que se va a emplear. Es importante que sepamos la diferencia entre masa y peso. La masa es una medida de la cantidad de sustancia y para un cuerpo dado es la misma en cualquier parte del Universo. El peso es la fuerza de atracción gravitatoria que ejerce la tierra (puede ser otro planeta o cuerpo celeste) sobre un cuerpo, equivalente a su masa por la aceleración de la gravedad y en lugares con una fuerza gravitatoria diferente, los pesos son diferentes.
Otra determinación sencilla e importante para identificar sustancias, es la determinación de su densidad. Para ello debemos medir la masa de u volumen determinado de la sustancia y determinar la densidad como el cociente de la masa entre el volumen:
![]()
Para las sustancias líquidas un procedimiento adecuado es la utilización del picnómetro. hay deiferentes tipos (figura 5), pero todos tienen el mismo principio de funcionamiento. la determinación se realiza pesando vacío el picnómetro, lleno de agua destilada (se observa la temperatura y conociendo la densidad exacta del agua a esa temperatura se tiene el volumen del picnómetro) y lleno con la sustancia para determinar por diferencia con el picnómetro vacío la masa de sustancia. Teniendo la masa de sustancia y el volumen que ocupa a una temperatura dada, se determina su densidad a la temperatura de ensayo. Un procedimiento aceptado puede ser emplear un vial que nos indique el volumen con exactitud, digamos un ml, pesarlo vacío, añadir 1 ml de la sustancia y volver a pesar.

Figura 5. Picnómetros.
Relacionadas con la densidad tenemos el peso específico y la gravedad específica. El peso específico. Pe, de una sustancia se define como su peso por unidad de volumen. Evidentemente sus unidades serán de fuerza por unidad de volumen (en el SI será de N m-3), Resulta evidente que es una magnitud diferente a la densidad, aunque relacionada directamente por la ecuación Pe = d×g, siendo g la aceleración de la gravedad en el lugaren que se determina el peso específico. La gravedad específica se define como el cociente de la densidad de una sustancia dada a la densidad de agua, cuando ambos están en la misma temperatura, es por lo tanto una cantidad sin dimensiones.
El índice de refracción es otra propiedad fácil de medir y que nos caracteriza a una sustancia. El fenómeno de la refracción tiene su origen en que la velocidad de la luz en dos medios de características de propagación diferentes es también diferente, lo que ocasionara que ocurra el fenómeno de la refracción o sea que el ángulo de incidencia de la luz con la normal en la superficie será diferente al ángulo de salida (motivo por el cual si usted coloca un objeto en un recipiente transparente con agua, notará como si el objeto se “cortara” en la interfase aire agua. Expresado en una fórmula (ver figura 5):
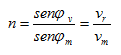
donde los subíndices r y m se refieren al vacío o el aire y al medio, respectivamente.
Para esta determinación se utilizan los refractómetros, que tienen diferentes diseños, desde equipos de mano (figura 6) hasta equipos de mesa provistos de accesorios para mantener temperaturas constantes en los prismas y la muestra. Hoy en día se dispone de refractómetros basados en la técnica de fibra óptica (figura 7), lo que lleva esta determinación a un grado de sencillez muy alto.
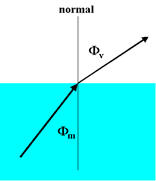


Figura 5 Figura 6 Figura 7
Una vez determinadas las propiedades de las sustancias, comparamos con los valores que se encuentran en la literatura y tenemos una identificación (o caracterización primaria según sea el caso), de la sustancia que estamos estudiando.
Las propiedades químicas de las sustancias son aquellas propiedades distintivas de las que se observan cuando reaccionan. Mucho dependen de la sustancia que deseamos definir o analizar. Por ejemplo si hablamos de un combustible nos interesa su poder calorífico, o sea cuánta energía libera por unidad de masa al quemarse en una atmósfera de un oxidante. Si hablamos de un ácido, nos puede interesar su corrosividad y más específicamente al atacar a un tipo determinado de material. Si hablamos de un lubricante, nos puede interesar su punto de inflamación, o sea la temperatura a la cual, bajo condiciones experimentales controladas, al acercar una llama a la superficie del lubricante, este se inflama. Si hablamos de un acero, nos puede intersar su resistencia a la corrosión en un ambiente determinado. Si hablamos de un alimento, nos puede interesar determinar su resistencia a participar en reacciones de oxidación que pueden conducir a la alteración de sus propiedades. Y así se puede enumerar muchas propiedades químicas de las sustancias y materiales, dependiendo del uso o interés que se tiene al estudiarlos. Por tanto hay muchos métodos diferentes de estudio de estas propiedades según sea la propiedad química que desamos determinar y en que contexto queremos determinarla.
Es conveniente mencionar que la determinación de las propiedades, en particular las químicas, es muy relevante cuando nos referimos a los residuos de las actividades productivas y de todo tipo del hombre. Según la Norma Oficial Mexicana NOM-052-SEMARNAT-2005, un residuo es peligroso si presenta al menos una de las siguientes características, bajo las condiciones señaladas dentro de sus numerales: - Corrosividad - Reactividad - Explosividad - Toxicidad Ambiental - Inflamabilidad - Biológico-Infecciosa, lo que se resumen en que se hace un análisis CRETIB (por las iniciales de las propiedades mencionadas). Por la incidencia en la actividadproductiva y la generación o tratamiento de residuos que van a tener los diferentes especialistas que se forman en las Universidades Tecnológicas, en el menú correspondiente tienen acceso al texto de la NOM-052.