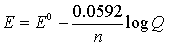
Pilas y baterías
Se llama celda galvánica, electroquímica o pila a todo dispositivo que origina una corriente eléctrica, debido al paso de electrones de un reductor a un oxidante a través de un circuito externo. Como se vió anteriormente esto se logra utilizando dos electrodos. En uno ocurre la reacción de oxidación y los electrones que pasan a ese electrodo, se dirigen por el circuito al otro electrodo donde ocurre la reacción de reducción. El electrodo en que ocurre la oxidación se denomina ánodo y el electrodo en que ocurre la reducción se denomina cátodo. En todas las pilas hay una separación entre los electrodos para evitar un corto circuito y también un medio salino con iones que no intervienen en el proceso para permitir el cierre del circuito y mantener la electroneutralidad.
Para escribir en notación convencional una pila se utiliza un diagrama de celda, se pone el ánodo a la izquierda y el cátodo a la derecha, siguiendo el flujo de los electrones e indicando en ambos casos el proceso redox que tiene lugar, separando las fases de cada media reacción por una raya vertical y se indica si hay un puente salino o tabique poroso por dos rayas. En cada proceso se escribe primero el reaccionante y después el producto. Se indica el electrodo, la concentración de las especies iónicas (si se tiene la información) y si hay alguna sustancia gaseosa. Cuando el proceso de alguno de los electrodos se realiza con la intervención de iones, es necesario utilizar un electrodo inerte, que intercambia electrones con la disolución, pero no iones, que puede ser de platino u otro material adecuado. A la derecha se puede escribir el potencial de la pila. Algunos ejemplos:
Fe(s) | Fe2+(aq), 1M || Pb2+(aq), 1M | Pb(s)
Pt | Cu+, 1M, Cu2+, 1M || Fe3+, 1M, Fe2+, 1M | Pt
Sn(s) | Sn2+(aq) || HNO3(aq) | NO(g) | Pt(s)
La ecuación de Nernst
De acuerdo a lo visto, podemos calcular la fuerza electromotriz (FEM), de una pila a partir de los potenciales de las medias reacciones de cada electrodo de la pila. La experiencia práctica nos indica que las pilas se agotan. También es lógico que podamos analizar, dado que los procesos en los electrodos son reacciones en equilibrio, que este potencial debe cambiar con la concentración. Es evidente que el voltaje del proceso que ocurre en el cátodo del par zinc/cobre que hemos visto:
Cu2+(aq) + 2e- ↔ Cu(s)
debe ir disminuyendo cunado la concentración de Cu2+ va disminuyendo. Además muchos procesos se realizan en condiciones que no son las estándar.
La termodinámica nos indica que para un proceso a P y T constantes se cumple que la variación de la energía libre es igual al trabajo que se puede obtener del sistema:
DG(P,T) = – DW
Además, para el trabajo e eléctrico se cumple que DW = qDV y en una pila DV = E. La carga q, en culombios, es igual al número de electrones n que se intercambian en la reacción redox por el número de faradios, F (la carga eléctrica que transporta un mol de electrones, igual a 96500 culombios), que circulan en la pila, q = nF. Sustituyendo en la expresión de DG, queda:
DG(P,T) = – nFE
La termodinámica también nos dice que para un proceso fuera de las condiciones del equilibrio:
DG(P,T) = DG0 + RTln Q
Siendo Q la relación de las concentraciones, tal como aparece en la constante de equilibrio.
Considerando que por analogía DG0 = – nFE
– nFE = – nFE0 + RTlnQ y E = E0 – (RT/nF)lnQ
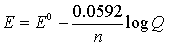
Debe considerarse que
La ecuación de Nernst nos permite calcular el potencial de una celda cuando las concentraciones son diferentes a 1M y por consiguiente cuando han cambiado en el tiempo. También permite darnos cuenta, que utilizando una misma reacción redox, si las concentraciones en los dos electrodo son diferentes, podemos obtener un voltaje. Estos sistemas son denominados pilas de concentración.
Consideremos la misma pila Zn-Cu en la cual, inicialmente, las concentraciones de las soluciones de Cu2+ y Zn2+ eran 1M. Transcurrido un cierto tiempo de trabajo las concentraciones son [Cu2+] = 0.1 y [Zn2+] = 1.9. Determinemos el nuevo potencial de esta pila, que inicialmente tenía 1.1 V.
Escribiendo el proceso que ocurre:
Cu2+(aq) + Zn(s) Cu(s) + Zn2+(aq)
y utilizando la ecuación de Nernst obtenemos:
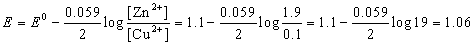
Y se observa como el uso de la pila conduce a la disminución gradual del potencial que suministra, o sea a su agotamiento.
Nótese que en el equilibrio DG(P,T) = 0, como DGº = – nFE0 = – RTln Keq y entonces E0 = (RT/nF) lnKeq y la determinación del potencial estándar nos permitirá obtener el valor de la constante de equilibrio del proceso redox.
Veamos un ejemplo de una pila de concentración.
Consideremos la pila Ag | Ag+ (10–4 M) || Ag+ (10–2M ) | Ag
El potencial estándar del sistema Ag+/Ag = 0.8 V. El proceso global que se produce es:
Ag+ (10-2 M) ↔ Ag + (10-4 M)
Aplicando la ecuación de Nernst, considerando que en condiciones estándar, el potencial de este sistema es 0 (las dos reacciones son iguales), queda:
E = E0 – (0.059/1)×log(10-4/10-2) = 0 – 0.059×(-2)
E = 0.118 voltios
Siendo E > 0, vemos que es un proceso espontáneo y este es un ejemplo de una pila de concentración.
Algunas pilas y baterías de importancia
Aunque se utilizan para obtener energía eléctrica a partir de la energía química latente en la presencia de un par de reacciones redox, no es lo mismo una pila que una batería. Una pila es una celda primaria que produce electricidad durante un proceso químico irreversible. Las pilas pueden ser húmedas o secas, según que el electrolito esté libre, en forma líquida o absorbido en un medio poroso. Las baterías son celdas secundarias que producen electricidad por un proceso reversible y es posible recargarlas varias veces, conectándolas con una fuente de corriente eléctrica. Casi todas las reacciones redox se pueden emplear para la construcción de pilas, aunque solamente algunas de ellas son rentables económicamente.
La pila Daniell.
Creada en 1836, fue la primera pila con una vida de anaquel considerable. Consta de dos electrodos, uno de cinc y otro de cobre, formados por sendas barras de Zn y de Cu, sumergidas en recipientes que contienen disoluciones acuosas de ZnSO4 y CuSO4, respectivamente. Su potencial estándar es de 1.1 V.
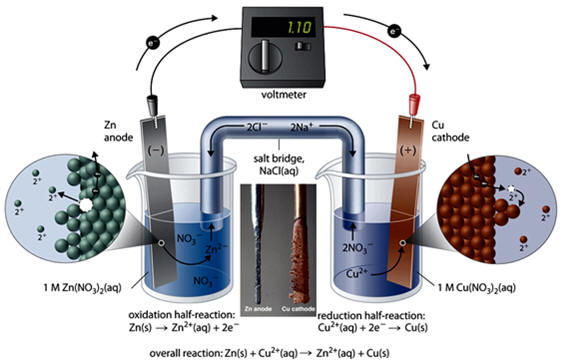
Pila Daniell.
Imagen tomada de http://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/s23-electrochemistry.html
Pila seca
El cátodo es una pasta humedecida formada por MnO2, ZnCl2, NH4Cl y polvo de carbón, con una barra de C (grafito) que hace de electrodo inerte, mientras que el ánodo es el propio recipiente de la pila que es de cinc.
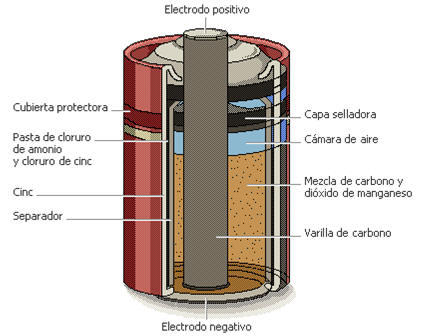
Pila seca.
Imagen tomada de https://despertandoconcienciaplanetaria.wikispaces.com/Pilas-Bater%C3%ADas
En esta pila no hay disoluciones por lo que se le dio el nombre de pila seca. Las reacciones que tienen lugar en los electrodos son:
Ánodo (-): Zn ↔ Zn2+ + 2e-
Cátodo (+): 2 MnO2 + 2H+ + 2e- ↔ Mn2O3 + H2O
Los iones H+ proceden de la reacción NH4Cl → NH3(g) + H+ + Cl-
La pila seca presenta algunos problemas de corrosión: El envase de cinc se deteriora progresivamente y se hincha debido a la acidez del NH4Cl y al NH3(g) que se va formando, lo que hace que la pila pueda descargarse aunque no se utilice. También se produce: NH3 + Zn2+ → Zn(NH3)42+.
Pila alcalina.
Son de mayor costo que la anterior, aunque tienen mayor densidad de energía y vida de anaquel. Las reacciones son:
Ánodo (oxidación, -): Zn(s) + 4OH- ↔ Zn(OH)42- + 2e-
Cátodo (reducción, +): 2MnO2(s) + 2H2O + 2e- ↔ Mn2O3∙H2O + 2OH-
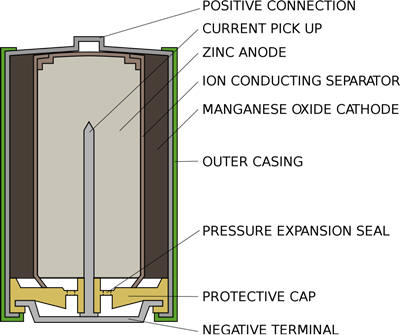
Pila alcalina.
Imagen tomada de https://en.wikipedia.org/wiki/Alkaline_battery
Pilas de botón.
Utilizan generalmente como oxidantes el HgO y Ag2O que son más caros que el bióxido de manganeso. El electrolito es hidróxido de potasio al 50%
En el ánodo (-) Zn + 4OH - ↔ Zn(OH)4-2 +2e-
En el cátodo (+) HgO + 2e- + 2H2O ↔ Hg + 2OH- ; Ag2O + 2e- + H2 O 2Ag + 2OH-
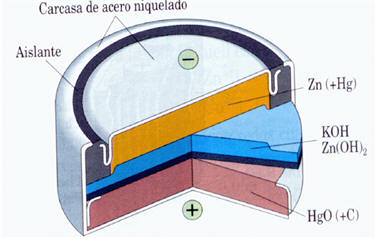
Pila de botón.
Imagen tomada de http://html.rincondelvago.com/problematica-de-las-pilas.html
El acumulador de plomo.
Está formado por una serie de láminas de plomo (polo negativo, ánodo), alternando con otras de dióxido de plomo (polo positivo, cátodo), y sumergidas ambas en una disolución acuosa de H2SO4 al 20, por lo que la reacción química transcurre en medio ácido. Las ½ reacciones son (dado que es una batería es recargable, por lo que se indica el sentido durante su uso, descarga y durante su carga):
En el ánodo (-): Pb + SO42- ↔ PbSO4 + 2e- [→ descarga; ← carga]
En el cátodo (+): PbO2 + SO42- + 4H+ + 2e- ↔ PbSO4 + 2H2O [→ descarga; ← carga]
La reacción global que transcurre es: Pb + PbO2 + 2 H2SO4 2 PbSO4 + 2H2O y la FEM de la batería es de 2.1 V. Si se conectan 6 baterías en serie, por ejemplo, tenemos un acumuldor de 12 V. Dado que durante el uso ambas reacciones van hacia la derecha, los electrodos se van cubriendo de una fina capa de sulfato de plomo, por lo que se dice que se van sulfatando. Esto disminuye la densidad del electrolito, por lo que si medimos su densidad (1.280 g mL-1 cuando está cargado), podemos saber si est+a cargado o descargado.
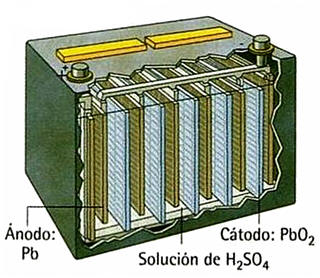
Acumulador de Pb.
Imagen adaptada de http://www.monografias.com/trabajos89/la-electroquimica/la-electroquimica.shtml
Conectando el acumulador a una fuente exterior de forma que pase la corriente en sentido contrario se invierte el sentido de las reacciones y se regeneran los componentes en ambas placas.
Electrolisis
Cuando tenemos un proceso redox no espontáneo, podemos hacer que tenga lugar si le suministramos la energía necesaria mediante el paso de una corriente eléctrica continua a través del electrolito en el que se encuentran las especies objetivo. La electrolisis se lleva a cabo un recipiente, provisto de dos electrodos inertes (barras conductoras de un metal cualquiera o de grafito) conectadas a un generador de corriente continua (pila o batería). El electrodo con carga positiva es el ánodo ( a él se dirigen los aniones) y ahí ocurre la oxidación. En el cátodo (con carga negativa y hacia el que se dirigen los cationes), ocurre la reducción. Hay que tomar en cuenta que de todas las reacciones posibles a ocurrir en alguno de los electrodos, ocurre la que involucre la menor energía, aunque algunos factores cinéticos y de otra índole pueden alterar dicho orden. Veamos algunos ejemplos.
Electrólisis del NaCl fundido.
Las reacciones son:
Ánodo (+, oxidación) 2Cl- → Cl2(g) + 2e- E0 = –1.36 V
Cátodo (-, reducción) 2Na+ + 2e- → 2Na E0 = –2.71 V
Como ocurre la reacción inversa a la reacción espontánea, sólo tenemos que invertir los potenciales de la misma, obteniendo un valor de –4.07 V. Por tanto para que la electrolisis tenga lugar, la FEM del generador tiene que ser mayor de 4.07 V.
Electrólisis del agua.
El agua pura tiene muy pocos iones (10-7 mol L-1 de OH- y de H+ respectivamente), por lo que no es buena conductora de la corriente. Si le añadimos una pequeña cantidad de un electrolito, digamos sulfato de sodio esto se resuelve y ocurren las reacciones:
Ánodo (+): 2H2O(l) → O2(g) + 4H+(aq) + 4e- E0 = -1.23 V
Cátodo (-): 2H2O(l) + 2e- ↔ H2(g) + 2OH-(aq) E0 = -0.83 V
Los iones sulfato presentes no se oxidan en el ánodo, pues necesitan un potencial mucho mayor. Igualmente los cationes sodio necesitan mucha mayor energía que el agua para reducirse en el cátodo.
Electrólisis de una disolución acuosa de NaCl concentrado (salmuera).
En el ánodo pueden ocurrir las siguientes reacciones:
2Cl- → Cl2(g) + 2e- E0 = –1.36 V
2H2O(l) → O2(g) + 4H+(aq) + 4e- E0 = -1.23 V
En el cátodo:
2H2O(l) + 2e- → H2(g) + 2 OH- E0 = –0.83 V
2Na+ + 2e- → 2Na E0 = –2.71 V
Deberíamos esperar que en el ánodo se liberara oxígeno y en el cátodo hidrógeno. Lo segundo ocurre, pero experimentalmente se observa que se desprende cloro. Esto se debe al efecto de la concentración de Cl- en el potencial, pues al ser mayor que la concentración del estado estándar, hace más pequeño el potencial de la reducción. En disoluciones diluidas se observa el desprendimiento de O2. La electrolisis de las salmueras es un método industrial para la obtención de sosa (NaOH) y cloro.
Las leyes de Faraday.
Los procesos electrolíticos vienen regidos por las leyes de Faraday, que son las siguientes:
La cantidad de sustancia oxidada o reducida en un proceso electrolítico es directamente proporcional a la cantidad de electrones que circulan;
Los pesos de diferentes sustancias depositadas o desprendidas en los electrodos al paso de una misma cantidad de corriente eléctrica son proporcionales a los pesos equivalentes de las distintas sustancias.
Estas leyes se basan en que el paso de un mol de electrones (1 faradio) son 96500 culombios y esto equivale precisamente a un equivalente de la sustancia en cuestión que se oxida o reduce. Entonces, si pasamos una corriente de intensidad I (en amperes, 1 ampere es 1 culombio s-1), durante t segundos, tendremos:
Masa transformada en un electrodo= (I×t×MM/n)/96500
Siendo MM la masa del mol de sustancia que se transforma (sea una especie molecular, un ión politómico o un ión monoatómico) y n el número de electrones involucrado en la ½ reacción.
Veamos un ejemplo. ¿Qué cantidad de Zn se deposita en el cátodo y cuánto O2 a TPN se libera en el ánodo durante la electrolisis de una disolución de ZnSO4, si se pasa una corriente de 4 amperios durante 1 hora.
Reacciones:
Zn2+(aq) + 2e- ↔ Zn(s)
2H2O(l) ↔ O2(g) + 4H+(aq) + 4e-
De la ley de Faraday: masa de Zn = (4*3600*65.4/2)/96500= 4.88 g
Operando como ya se vió en estequiometría, 22.4 L de O2 se liberan al paso de 4 moles de electrones, entonces:
Volumen de O2 = (4*3600*32/4)/96500 = 0.836 L de O2 a TPN