Formas de expresar la concentración de las disoluciones.
Para el análisis químico es necesario en muchas ocasiones llevar nuestro analito a una forma disuelta en un solvente adecuado. También se emplean muchas soluciones de diferentes reactivos, por lo que es muy importante expresar y calcular la concentración de las soluciones.
Cualquiera sea la forma de expresar la concentración, esta referirá la cantidad de soluto disuelto en una determinada cantidad de disolvente o disolución. Dado que estas cantidades pueden expresarse en unidades de masa, cantidad de sustancia o volumen, la concentración de una disolución puede expresarse de diferentes formas. Las definiciones de estas son (en las expresiones se utiliza X- soluto; d- disolvente; D- disolución):
Porcentaje masa/masa, % m/m: Expresa la masa de soluto por cada 100 gramos de disolución:
![]()
Por ejemplo, una solución de cloruro de sodio que se prepara disolviendo 1 g de esta sustancia en 99 g de agua es una solución al 1% m/m. Cuando no se multiplica por 100 se obtiene la fracción másica o tanto por uno.
Fracción molar XX: Es la relación entre el número de moles de soluto disuelto y la suma de los moles de soluto y de disolvente:
![]()
Así la disolución anterior de NaCl tendrá fracción molar igual a:
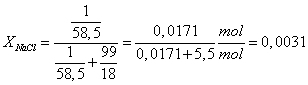
Molalidad: Es la relación entre la cantidad de moles de soluto y la masa de disolvente expresada en kg:
![]()
Entonces la disolución mencionada de NaCl tendrá una molalidad:
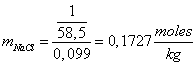
Porcentaje volumen/volumen, % v/v: Es la relación entre el volumen de soluto disuelto multiplicado por 100 y el volumen de la disolución, medidos a igual temperatura y presión.
![]()
Así una disolución de diclorometano en cloroformo que contiene 150 ml de diclorometano por cada litro de disolución es una disolución al 15 % v/v. Al igual que el porcentaje en masa si no se multiplica por 100 se obtiene la fracción volumétrica.
Concentración másica: Es la relación entre la masa de soluto y el volumen de la disolución:
![]()
Para soluciones muy diluídas resulta conveniente utilizar como manera de expresar la concentración de la solución en partes por millón, que definimos como:
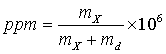
en donde mS es el número de gramos de soluto y mD el número de gramos de solvente. Como por lo general mS es muy pequello comparado con mD, esto se convierte en:
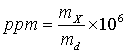
Como un litro de agua a temperatura ambiente pesa aproximadamente 106 mg, un mg de soluto en un litro de agua está en una concentración de alrededor de una ppm, o sea la concentración en ppm resulta equivalente a expresar la concentración en mg/L.
De manera similar se pueden expresar las concentraciones en partes por billón.
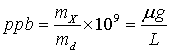
Molaridad: Expresa la cantidad de moles de soluto por litro de disolución.
![]()
Normalidad: Expresa la cantidad de equivalentes-gramo de una sustancia que hay por litro de disolución:
![]()
El equivalente gramo de una sustancia está relacionado con la cantidad de la misma que se involucra en una reacción. Abordaremos posteriormente como se determina el equivalente gramo.
El término por ciento en masa se emplea comúnmente para expresar la concentración aproximada de los reactivos de laboratorio. Para soluciones muy diluidas es conveniente utilizar unidades de partes por millón o partes por billón. Para el estudio de las propiedades coligativas de las disoluciones y los cálculos de potenciales químicos se utilizan la fracción molar y la molalidad. La molaridad y la normalidad son los términos de concentración que se utilizan con más frecuencia en los análisis cuantitativos y por ello serán vistos en mayor detalle.