EL CICLO RANKINE
Ciclos de Vapor.
El uso de vapor como fluido termodinámico se justifica por una gran variedad de propiedades entre ellas que es abundante y relativamente barato de producir. Además debido al cambio de fase transporta una gran cantidad de energía por unidad de masa. La variación de entalpía del agua al pasar de líquido saturado a vapor saturado a la presión de 1.015 bar, calculada por las tablas de saturación es de 2256.4 kJ/kg.
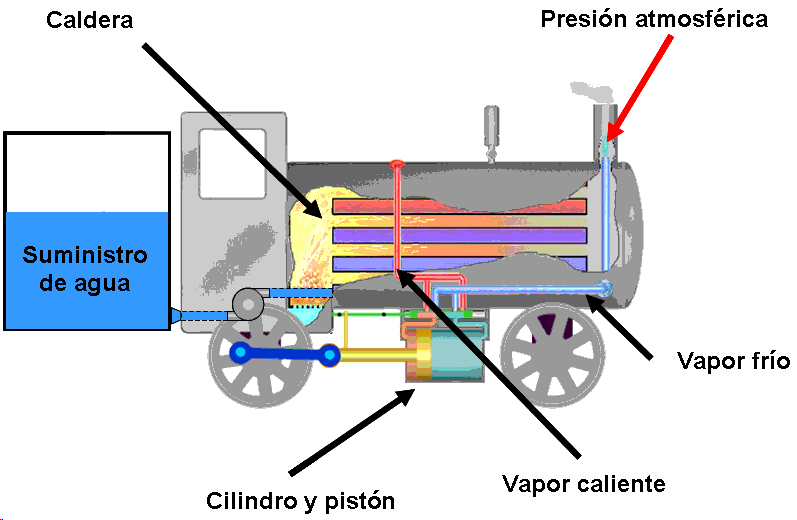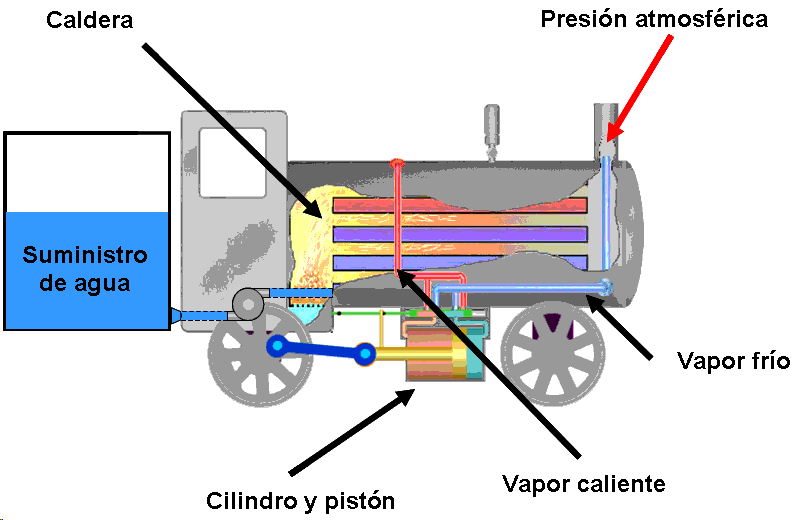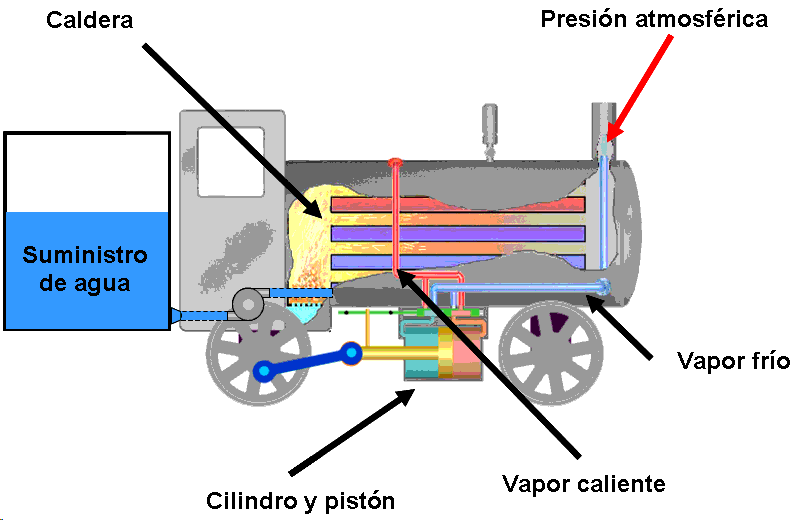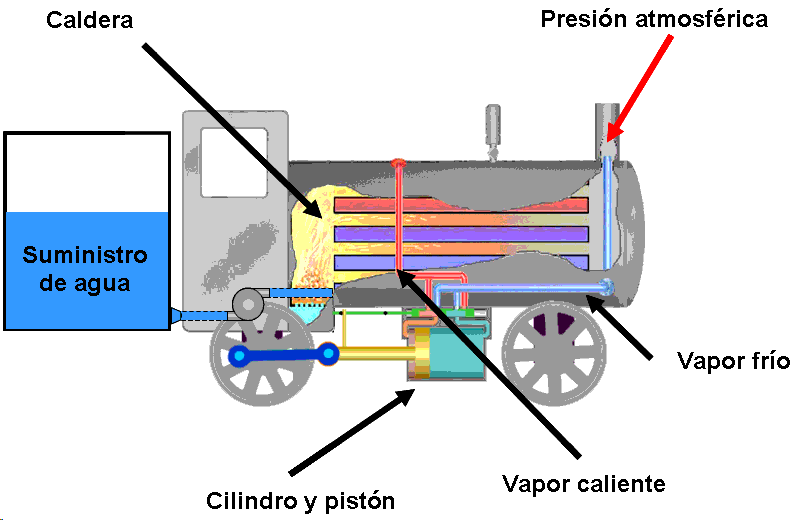
Un ciclo de vapor conocido es el de las locomotoras de vapor, que se ilustra en la figura siguiente.

El agua es bombeada a la caldera donde se evapora y sale caliente. En el grupo cilindro-pistón hace el trabajo mecánico y se enfria, siendo expulsado como vapor húmedo a la atmósfera.
Ciclo Rankine.
El ciclo de Rankine es parecido, pero con la diferencia de que se introduce un condensador. Este tiene por efecto bajar la temperatura del depósito de calor a baja temperatura a una TF inferior a la que se tiene, por ejemplo, en el ciclo de la locomotora de vapor, lo que evidentemente mejora la eficiencia del ciclo. Además, la presión en el condensador es muy inferior a la atmosférica, lo que hace que se trabaje con una variación de presión mayor, lo que aumenta la cantidad de trabajo que se puede extraer por unidad de masa de vapor. El ciclo se ilustra en la siguiente figura.
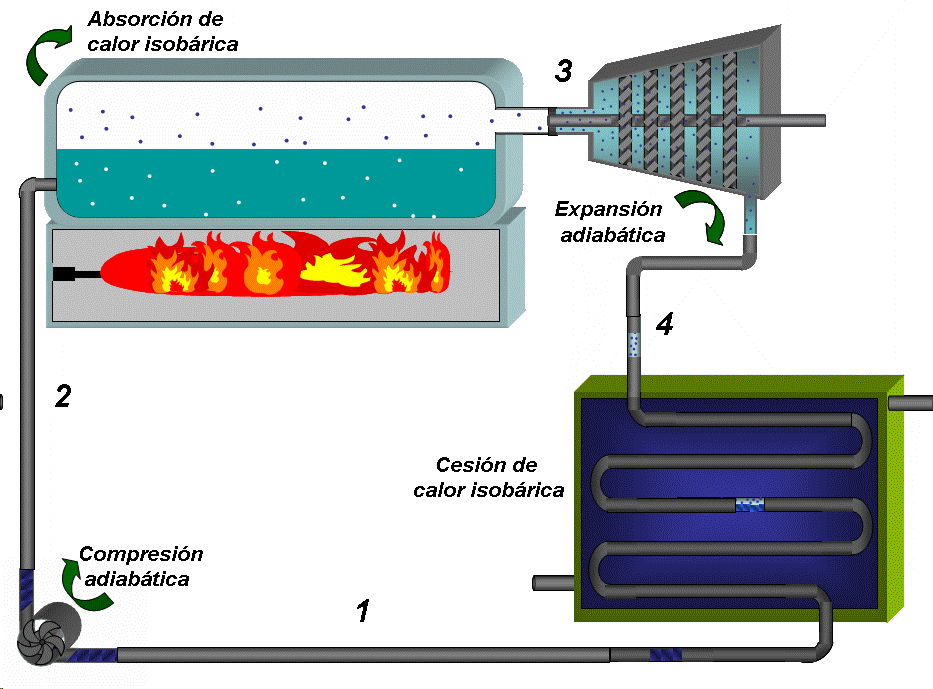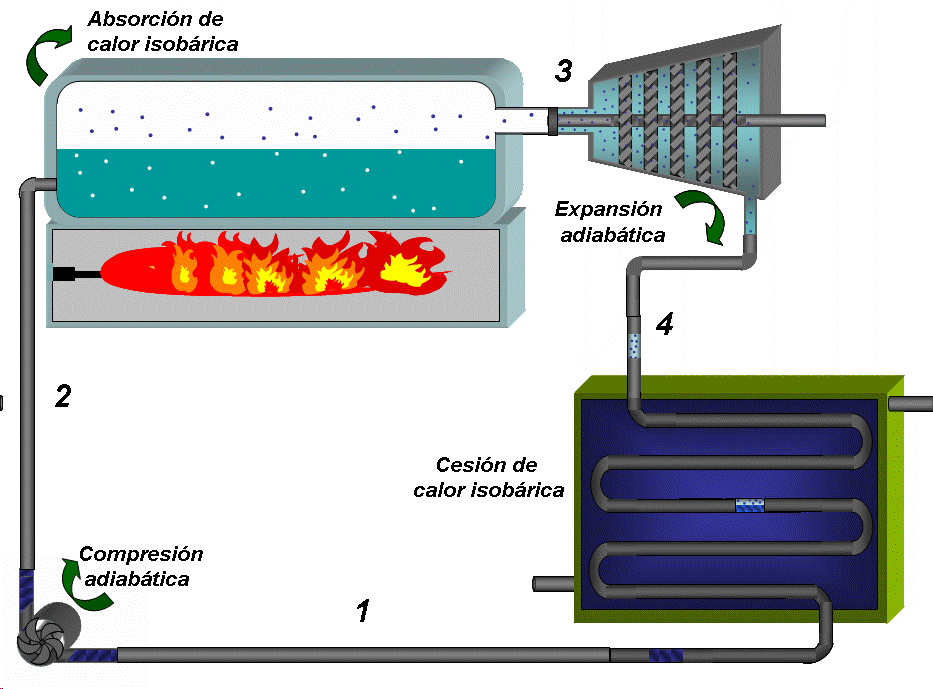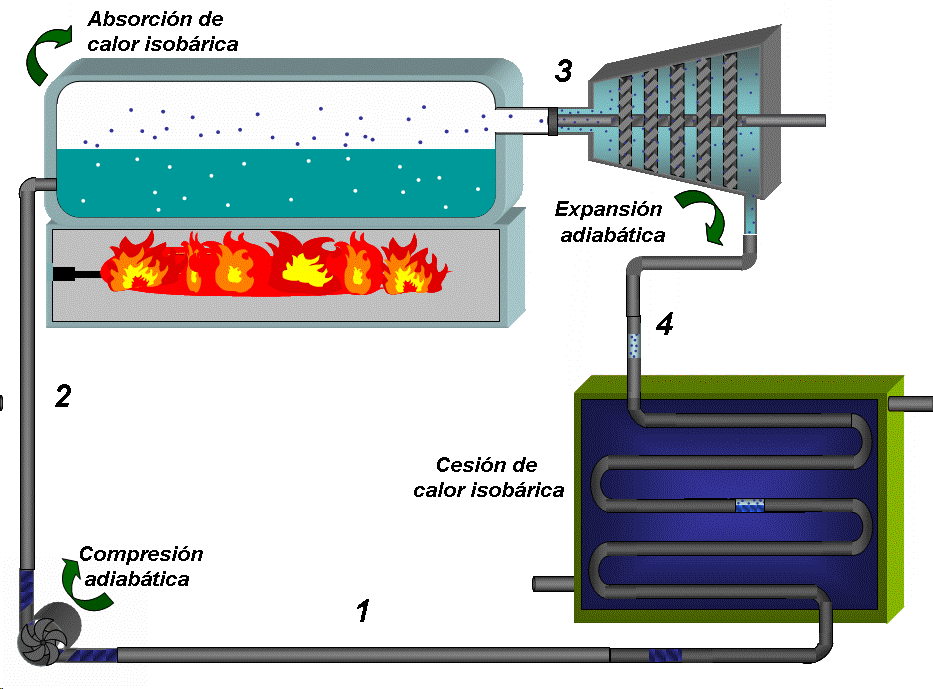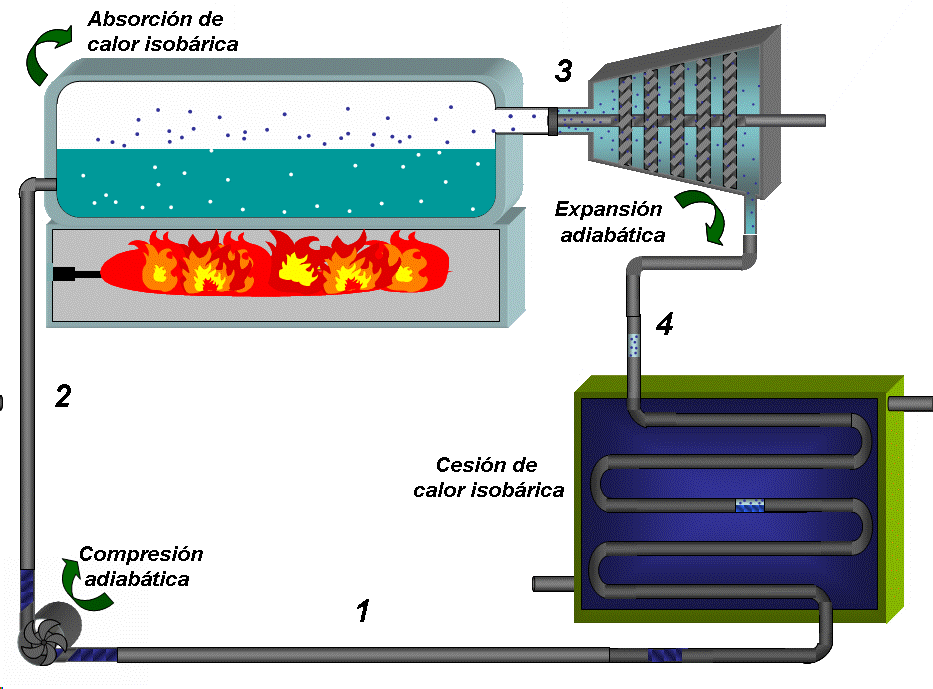

Este ciclo resulta más práctico que el ciclo de Carnot con gas pues la capacidad de transporte de energía del vapor con cambio de fase es mucho más grande que en un gas. Para la descripción del ciclo nos apoyaremos en los diagrama TS y PV que se muestran a continuación.
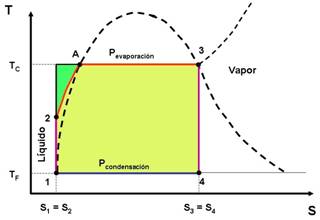
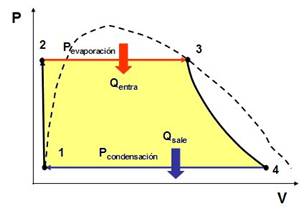
Se tienen las siguientes etapas.
Compresión adiabática 1 →2:
La bomba colecta condensado a baja presión (menor que la atmosférica) y baja temperatura, que es el estado 1 y comprime el agua hasta la presión de la caldera (estado 2), lo que requiere de un trabajo que denominaremos como Wentra.
Absorción de calor a P = constante 2 →3:
El condensado a menor temperatura que la de saturación prevaleciente en la caldera, se inyecta en esta última. En la caldera primero se calienta, alcanzando la saturación (que se representa por el punto A en el diagrama TS) y luego se inicia la ebullición del líquido. Todo este proceso requiere del suministro de calor que denominaremos como Qentra. El vapor que se extrae de la caldera (con un título muy cercano a 1) constituye el estado 3.
Expansión adiabática hasta la presión de condensación 3 → 4:
El vapor se conduce a la turbina donde se expande hasta la presión asociada a la temperatura de condensación, generando trabajo, que denominaremos como Wsale.
Cesión de calor a presión constante 4 → 1:
El vapor que descarga la turbina, que constituye el estado 4 entra al condensador donde se convierte en agua al entrar en contacto con las paredes de tubos que están refrigerados en su interior (típicamente por agua), entregándose una cantidad de calor a la temperatura TF que denominaremos como Qsale. El condensado se colecta en el fondo del condensador, donde se extrae prácticamente como líquido saturado que se dirige a la bomba y se repite el ciclo..
Las modificaciones prácticas al ciclo de Carnot que correspondería son que se realiza la compresión en la zona del líquido y que los intercambios de calor se realizan a presión constante en vez de a T constante (ver diagrama PV).
En el diagrama TS, podemos comparar el ciclo Rankine con el correspondiente de Carnot (enmarcado por las dos rectas isotérmicas y las dos isoentrópicas), observándose que hay un área mayor para el de Carnot. La diferencia es señalada en verde en el diagrama TS y se debe a la operación del calentamiento del líquido en la caldera (2 → A). Es evidente que mientras más alta sea TC, o sea mientras mayor se esté de la temperatura crítica (375 °C), mayor será el área de la diferencia entre los dos ciclos. Esto implica que se tendría que trabajar a las TC más alejadas en lo posible de la temperatura crítica. Entonces esto constituye una limitación del ciclo Rankine. Lo expuesto se ilustra en la siguiente figura donde se comparan dos ciclos a diferentes temperaturas en la caldera. Se ve que el ciclo con una temperatura más cercana a la crítica tiene una mayor diferencia con el ciclo de Carnot.
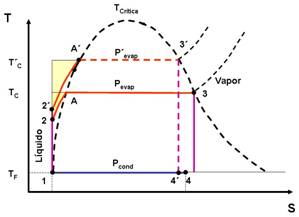
El rendimiento del ciclo real es menor que el del ciclo teórico, debido fundamentalmente a las siguientes irreversibilidades (sin pretender agotar la lista de las mismas):
La principal irreversibilidad que experimenta el fluido de trabajo está asociada con su expansión en la turbina. Aunque la turbina no es estrictamente adiabática, el calor transferido al ambiente por la turbina es normalmente una pérdida térmica de importancia secundaria. Una expansión real a través de la turbina va acompañada de un incremento de entropía y el trabajo desarrollado por unidad de masa en este proceso es menor que el correspondiente a una expansión isentrópica. Las irreversibilidades dentro de la turbina reducen significativamente el trabajo útil generado por la planta.
El trabajo requerido por la bomba para vencer los efectos de rozamiento, reduce el trabajo útil producido por la planta. En ausencia de transferencia de calor con el ambiente, la entropía crece a través de la bomba. El trabajo necesario para el proceso real es mayor que para el correspondiente proceso isentrópico. Como el trabajo de la bomba es mucho menor que el de la turbina, las irreversibilidades en la bomba tienen un impacto en el trabajo útil del ciclo mucho menor que las irreversibilidades en la turbina.
Las perdidas de calor en diferentes equipos de la planta también disminuyen el rendimiento real.
Cálculos del ciclo de Rankine:
La eficiencia del ciclo de Rankine se plantea como ya conocemos por:
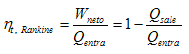
Para calcular la eficiencia del ciclo de Carnot equivalente vamos a expresar los calores absorbidos y cedidos en función de las entalpías y de los calores específicos a presión constante y las temperaturas. Tendremos que:
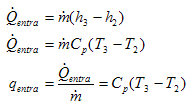 y
y
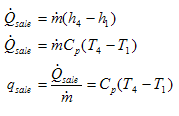
Sustituyendo y tomando en cuenta la conservación de la masa:
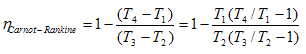
Como los procesos 1 → 2 y 3 → 4 son adiabáticos, se puede demostrar que:
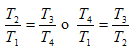
Finalmente:
![]()
La eficiencia del ciclo Rankine ideal debe ser menor que la expresada, pues el calor que se añade es mayor que el expresado arriba pues hay que calentar el líquido que entra a la caldera hasta la temperatura de ebullición. Algunos inconvenientes del ciclo se han resuelto introduciendo mejoras que conducen a una mayor eficiencia.
08/11/2012