Electroquímica
Los procesos electroquímicos
Cuando hablamos de electroquímica, estamos relacionando los fenómenos eléctricos y los químicos. Lógicamente esto nos conduce a asociar a los portadores de las cargas eléctricas, fundamentalmente a los electrones, con las reacciones químicas. Precisamente, al abordar las reacciones químicas vimos la importancia de las reacciones redox, en las cuales hay intercambios de electrones y por consiguiente cambios en los números de oxidación de los elementos presentes en las especies químicas involucradas. La combustión de muchas sustancias, la corrosión atmosférica, la obtención de sustancias a partir de los minerales, los procesos electrolíticos, la producción de la energía eléctrica por las baterías, los procesos de respiración celular, el metabolismo y muchos otros procesos industriales y naturales, involucran este tipo de reacciones.
Siguiendo la lógica del párrafo anterior, podemos pensar en procesos donde la transformación química sea la fuente de los electrones que darán lugar a una corriente eléctrica y también en procesos que sean generados por una corriente eléctrica. En el primer caso se tratará de procesos espontáneos, que podremos aprovechar para obtener energía. En el segundo caso, evidentemente, suministramos energía (por el potencial eléctrico que se aplica), posibilitando procesos no espontáneos, que no tienen lugar si no aplicamos la energía. Hablamos pues de las pilas galvánicas y baterías en el primer caso y de las celdas electrolíticas y la electrolisis en el segundo caso.
Potencial redox.
Evidentemente, las diferentes sustancias presentan diferentes tendencias a oxidarse o a reducirse. Si los ordenamos de acuerdo a ello, podremos tener un orden que nos permita predecir si al poner en contacto dos sustancias es posible que se produzca una reacción redox espontánea o que reacciones ocurrirán primero si aplicamos un potencial externo. Esta medida de la tendencia de una sustancia a oxidarse o reducirse se evalúa por su potencial redox. Ya vimos que los procesos de oxidación y reducción son procesos acoplados y todo electrón que sale de un proceso de oxidación tiene que terminar en un proceso de reducción. Entonces es imposible realizar una medida absoluta de la tendencia de una especie química a oxidarse o reducirse si no se acopla con otro proceso de índole contraria. La medición del potencial redox es por tanto una medida con respecto a un proceso de referencia. Este proceso de referencia es la oxidación del H2 o la reducción del ión H+, según la media ecuación:
2H+(aq) + 2e- ↔ H2(g)
A la misma se le ha asignado por la IUPAC un potencial de 0.000 voltios. Evidentemente, si unimos un proceso de oxidación o reducción con el del hidrógeno, utilizando dos electrodos en contacto con ambos procesos y un potenciómetro, si la tendencia a oxidarse o reducirse de dicho proceso es diferente a la de la media reacción del hidrógeno podremos observar una diferencia de potencial entre los electrodos y si se facilita el paso de los electrones, tendremos una corriente eléctrica. Estamos en presencia de una pila galvánica. Esta pila nos servirá para establecer una escala de los potenciales de reducción respecto al del hidrógeno.
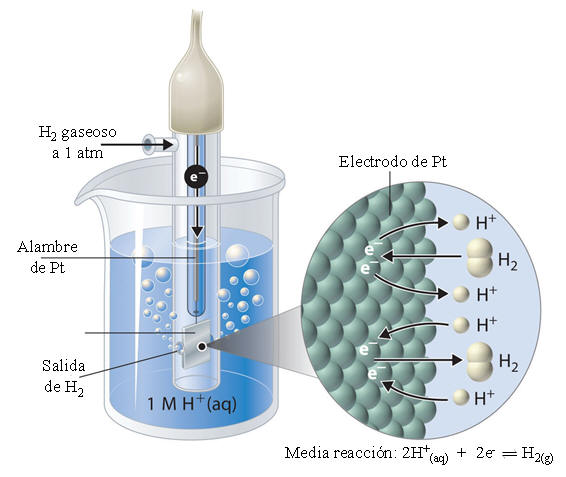
Sabemos que el hidrógeno es un gas. ¿Cómo hacemos entonces para tener un electrodo que se comporte como un electrodo de hidrógeno? La solución es utilizar un electrodo de platino, metal que disuelve muy bien al hidrógeno, en contacto con hidrógeno gaseoso. Lógicamente, para poder referir los valores a determinadas condiciones, se utiliza hidrógeno gaseoso a 1 atm y 25 ºC. El electrodo consiste de un alambre de Pt en cuyo extremo se encuentra una lámina de Pt recubierto de negro de Pt (forma reducida del Pt), lo que permite generar una gran área superficial (ca 200 m2). El electrodo se encuentra soldado a un tubo de vidrio que tiene un orificio de entrada por el que fluye hidrógeno gas a 1 atm de presión. En la parte inferior el tubo posee también orificios que permiten el burbujeo del hidrógeno gaseoso en la disolución y la acumulación de pequeñas burbujas de hidrógeno sobre la superficie rugosa del electrodo. El electrodo se sumerge en una disolución de iones H+ con una actividad igual a la unidad. En esta forma la superficie del electrodo se encuentra expuesta tanto al H2 como a los H+. Este electrodo, que se muestra en la figura que sigue, se representa convencionalmete:
Pt|H2 1atm| H+ 1M

Electrodo estándar de H2. Figura adaptada de http://chemwiki.ucdavis.edu/Analytical_Chemistry/Electrochemistry/Standard_Potentials
En la actualidad, dado el costo de este electrodo de referencia y conociendo que una vez que ubico una media reacción con respecto a la del hidrógeno, se utilizan otros electrodos de referencia que son calibrados frente al de hidrógeno.
La determinación del potencial de una media reacción consiste entonces en, utilizando un electrodo conveniente para dicha reacción, conectarlo a la celda de referencia y medir el potencial, como se ilustra en la siguiente figura, para la medición del potencial de reducción del Zn, por supuesto en condiciones estándar (25°C, 1 atm, actividad de Zn2+ 1].

Medición del potencial de reducción del Zn. Figura adaptada de http://chemwiki.ucdavis.edu/Analytical_Chemistry/Electrochemistry/Standard_Potentials
Entonces tendremos que
Zn2+(aq) + 2e- ↔ Zn(s) E0 = -0.76 v
Realizando la medición para muchas medias reacciones, con los electrodos apropiados, se obtiene la tabla de potenciales redox para muchas medias reacciones. En la siguiente figura se muestran algunas de ellas. En los materiales auxiliares se vincula una tabla más completa.
Algunos potenciales estándar.
|
Media reacción |
E0, voltios |
Media reacción |
E0, voltios |
|
F2(g) + 2e- ↔ 2F-(aq) |
2.87 |
ClO3-(aq) + H2O(l) + 2e- ↔ ClO2-(aq) + 2OH-(aq) |
0.35 |
|
O3(g) + 2H+(aq) + 2e- ↔ O2(g) + H2O(l) |
2.07 |
Cu2+(aq) + 2e- ↔ Cu(s) |
0.34 |
|
S2O82-(aq) + 2e- ↔ 2SO42-(aq) |
2.01 |
AgCl(s) + e- ↔ Ag(s) + Cl-(aq) |
0.22 |
|
Co3+(aq) + e- ↔ Co2+(aq) |
1.82 |
ClO4-(aq) + H2O(l) + 2e- ↔ ClO3-(aq) + 2OH-(aq) |
0.17 |
|
H2O2(aq) + 2H+(aq) + 2e- ↔ 2H2O(l) |
1.78 |
Cu2+(aq) + e- ↔ Cu+(aq) |
0.16 |
|
MnO4-(aq) + 8H+(aq) + 5e- ↔ Mn2+(aq) + 4H2O(l) |
1.49 |
Sn4+(aq) + 2e- ↔ Sn2+(aq) |
0.15 |
|
Ce4+(aq) + e- ↔ Ce3+(aq) |
1.44 |
2H+(aq) + 2e- ↔ H2(g) |
0 |
|
Cl2(g) + 2e- ↔ 2Cl-(aq) |
1.36 |
Fe3+(aq) + 3e- ↔ Fe(s) |
-0.04 |
|
Cr2O72-(aq) + 14H+(aq) + 6e- ↔ 2Cr3+(aq) + 7H2O(l) |
1.33 |
Pb2+(aq) + 2e- ↔ Pb(s) |
-0.13 |
|
O2(g) + 4H+(aq) + 4e- ↔ 2H2O(l) |
1.23 |
Sn2+(aq) + 2e- ↔ Sn(s) |
-0.14 |
|
Br2(l) + 2e- ↔ 2Br-(aq) |
1.07 |
Ni2+(aq) + 2e- ↔ Ni(s) |
-0.23 |
|
NO3-(aq) + 4H+(aq) + 3e- ↔ NO(g) + 2H2O(l) |
0.96 |
Cd2+(aq) + 2e- ↔ Cd(s) |
-0.4 |
|
ClO-(aq) + H2O(l) + 2e- ↔ Cl-(aq) + 2OH-(aq) |
0.9 |
Fe2+(aq) + 2e- ↔ Fe(s) |
-0.41 |
|
2Hg2+(aq) + 2e- ↔ Hg22+(aq) |
0.9 |
Cr3+(aq) + 3e- ↔ Cr(s) |
-0.74 |
|
Hg2+(aq) + 2e- ↔ Hg(l) |
0.85 |
Zn2+(aq) + 2e- ↔ Zn(s) |
-0.76 |
|
Hg22+(aq) + 2e- ↔ 2Hg(l) |
0.8 |
2H2O(l) + 2e- ↔ H2(g) + 2OH-(aq) |
-0.83 |
|
Ag+(aq) + e- ↔ Ag(s) |
0.8 |
Al3+(aq) + 3e- ↔ Al(s) |
-1.66 |
|
Fe3+(aq) + e- ↔ Fe2+(aq) |
0.77 |
Mg2+(aq) + 2e- ↔ Mg(s) |
-2.38 |
|
ClO2-(aq) + H2O(l) + 2e- ↔ ClO-(aq) + 2OH-(aq) |
0.59 |
Na+(aq) + e- ↔ Na(s) |
-2.71 |
|
I2(s) + 2e- ↔ 2I-(aq) |
0.54 |
Ca2+(aq) + 2e- ↔ Ca(s) |
-2.76 |
|
Cu+(aq) + e- ↔ Cu(s) |
0.52 |
K+(aq) + e- ↔ K(s) |
-2.92 |
|
IO-(aq) + H2O(l) + 2e- ↔ I-(aq) + 2OH-(aq) |
0.49 |
Li+(aq) + e- ↔ Li(s) |
-3.04 |
Nota: se usa el símbolo ↔ popr no haber encontrado uno más adecuado que no me diera error en la página.
De acuerdo a la serie presentada, la ½ reacción que tenga un mayor potencial de reducción, será la ½ reacción de reducción. Esto quiere decir que una ½ reacción irá hacia la derecha si tiene como complemento a cualquier otra con un potencial de reducción menor. Igualmente una ½ reacción transcurrirá como una oxidación (hacia la izquierda) frente a cualquier otra situada por encima de ella. Esto se ilustra en la siguiente figura, que nos muestra la dirección de la fuerza motriz de los procesos redox.
.

Utilizando los valores de la tabla, podemos predecir el sentido y el potencial de una reacción de oxidación-reducción espontánea. Veamos un ejemplo clásico. Supongamos que tenemos dos soluciones, una de Cu2+ 1M y otra de Zn2+ 1M, ambas a 25°C y 1 atm de presión, unidas por un puente salino y con placas del metal respectivo unidas por un voltímetro. Si analizamos los potenciales redox de ambas medias ecuaciones, E0(Cu2+/Cu) = 0.34 V y E0(Zn2+/Zn) = ‑ 0.76 V, resulta evidente que el Cu2+ actuará como un oxidante, depositándose cobre metálico en la placa de cobre. Correspondientemente el Zn se oxidará a Zn2+ y se observará la disolución de la placa de Zn. El proceso y su potencial se obtienen con las dos medias ecuaciones:
Cu2+(aq) + 2e- ↔ Cu(s) E0 = 0.34V
Zn(s) ↔ Zn2+(aq) + 2e- E0 = 0.76V
-------------------------------------------------------------
Cu2+(aq) + Zn(s) ↔ Cu(s) + Zn2+(aq) E0 = 1.1 V