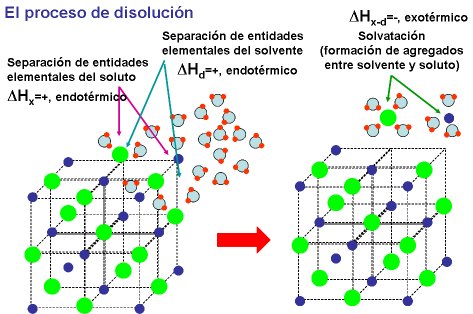
El calor o entalpía de disolución DHD será la suma de todas estas energías:
DHD = DHx + DHd + DHx-d
Siendo: DHs (entalpía de solvatación) = DHd + DHx-d
Mecanismo del proceso de disolución
Para que una sustancia se disuelva en otra es necesario separar las entidades
elementales que constituyen el soluto y el disolvente por separado, venciendo
las interacciones soluto- soluto y disolvente- disolvente y por otro lado se
establezcan interacciones soluto-disolvente, que sean más intensas que las
primeras. Se pueden diferenciar las siguientes etapas:
1.- Separación de entidades elementales del soluto.
2.- Separación de entidades elementales del disolvente.
3.-Solvatación (Atracción de entidades elementales del soluto y el disolvente).
Todo este proceso se ilustra en la siguiente figura donde se indican además las variaciones de entalpía (calores) de los procesos:

El calor o entalpía de disolución DHD será la suma de todas estas energías:
DHD =
DHx +
DHd +
DHx-d
Siendo: DHs (entalpía de solvatación)
= DHd +
DHx-d
Como regla
general se tiene que:
Si DHD >0 el proceso de disolución es endotérmico, por lo tanto el proceso de
disolución se favorece al aumentar la temperatura. Ejemplo: la disolución de
NH4NO3 en agua.
Si DHD < 0 el proceso de disolución es exotérmico, por lo que el proceso de
disolución se favorece al disminuir la temperatura.
Aunque esto no es así para todas las sustancias por lo que la influencia de la
temperatura en el proceso de disolución debe determinarse, en última instancia,
experimentalmente.
La velocidad del proceso de disolución depende de varios factores:
1.- La temperatura. Con el aumento de la temperatura aumenta la velocidad de disolución.
2.- La naturaleza del soluto y el solvente. Solventes que son capaces de disminuir las fuerzas existentes entre las partículas del soluto, aumentan la velocidad de disolución.
3.- El tamaño de partícula del soluto. A menor tamaño de partícula mayor velocidad de disolución pues aumenta la superficie de contacto entre el soluto y el disolvente.
4.- La agitación. La agitación favorece mecánicamente el proceso de disolución.
Solubilidad
Cuando se prepara una disolución a una presión y temperatura
determinada, se observa que para una cantidad de disolvente dado, el soluto se
va disolviendo hasta que llega un momento en que cualquier adición de soluto
se precipita en el fondo del recipiente. Cuando se alcanza esa condición se
dice que la disolución es saturada, es decir existe un equilibrio entre el
soluto disuelto y el soluto sin disolver, ya que la velocidad del proceso de
disolución es igual a la velocidad del proceso de separación. Si separamos la
fase líquida de la sólida (por ejemplo por filtración y la colocamos en un nuevo
recipiente, cualquier adición de soluto conlleva a la formación de una fase
sólida de igual masa, por estar saturada.
Cuando la disolución contiene menos soluto disuelto que la correspondiente
disolución saturada a una temperatura y presión dada, se dice que es no
saturada, y si contiene más soluto disuelto en esas condiciones de presión y
temperatura se dice que es sobresaturada. Bajo ciertas condiciones, se
obtienen soluciones sobresaturadas, que al afectar el sistema, precipitan.
Se define entonces la solubilidad como la cantidad máxima de soluto que puede
disolverse en una determinada cantidad de disolvente a una presión y temperatura
dada.
Factores que afectan la solubilidad
Entre los factores que afectan la solubilidad de las sustancias tenemos: la
naturaleza del soluto y el disolvente, la temperatura y la presión.
Naturaleza del soluto y el disolvente:
Cuando las fuerzas que interactúan entre las entidades elementales del soluto
y el disolvente por separado, no difieren mucho, se favorece el
establecimiento de interacciones entre las entidades elementales del soluto y
el disolvente y por lo tanto es mayor la solubilidad del soluto en el disolvente. Por
esta razón los solutos polares se disuelven generalmente en disolventes
polares y los poco polares en disolventes apolares. Esto se expresa
generalmente como “lo semejante disuelve lo semejante”.
Temperatura:
La dependencia de la solubilidad de una sustancia con la temperatura se
representa gráficamente por medio de las curvas de solubilidad.
En la figura siguiente se representan las curvas de solubilidad de varias
sustancias:
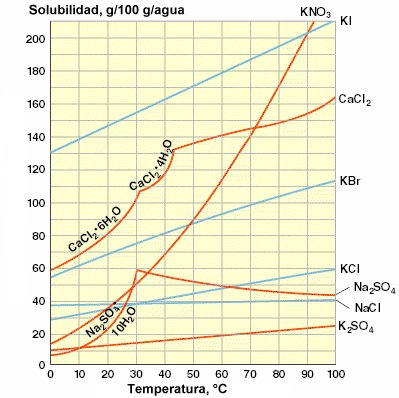
Los puntos sobre las curvas representan las composiciones de las disoluciones
saturadas correspondientes a las distintas temperaturas. Los puntos por debajo
de las curvas representan las disoluciones no saturadas y los puntos por
encima de la curva las disoluciones sobresaturadas.
Presión:
La presión sólo influye en el caso de solutos gaseosos. A temperatura
constante, un aumento de la presión aumenta la masa de gas disuelto y por lo
tanto aumenta la solubilidad. Esto se conoce como la ley de Henry. Es
corriente observar esto cuando abrimos un recipiente que contiene agua gaseada o
un refresco.